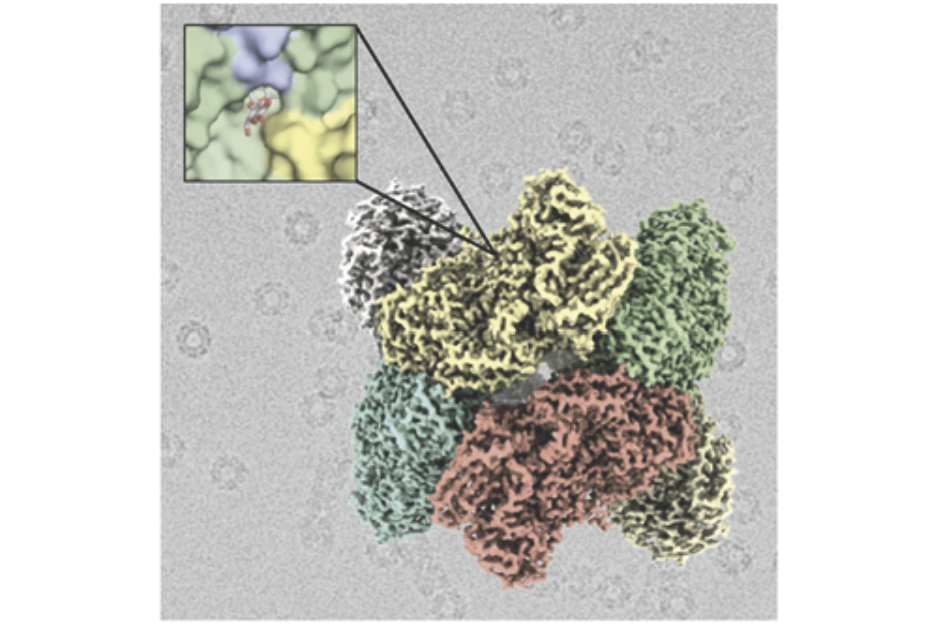
- Investigadores del CNIO y del CSIC han dilucidado mediante criomicroscopía electrónica la estructura molecular de una enzima termorresistente, que tiene la propiedad de hidrolizar la lactosa
- El hallazgo, que supone un avance significativo en el desarrollo de nuevos procedimientos para la obtención de leche y derivados lácteos sin lactosa, aparece publicado en la revista ACS Chemical Biology
Investigadores del Centro Nacional de Investigaciones Oncológicas (CNIO), del Instituto de Química-Física Rocasolano (IQFR) del Consejo Superior de Investigaciones Científicas (CSIC) y del Instituto de Agroquímica y Tecnología de Alimentos (IATA, CSIC), han dilucidado mediante criomicroscopía electrónica la estructura molecular de una enzima ß-galactosidasa, que no había podido ser resuelta mediante técnicas convencionales. Este enzima tiene la propiedad de hidrolizar la lactosa y está siendo utilizada en el desarrollo de dispositivos domésticos para convertir leche normal en leche sin lactosa. Los resultados del trabajo, que ha sido coliderado por Rafael Fernández-Leiro, del CNIO, y Julia Sanz-Aparicio, del IQFR-CSIC, aparecen publicados en la revista ACS Chemical Biology.
“La intolerancia a la lactosa es un trastorno digestivo común que afecta a una gran proporción de la población humana adulta. La gravedad de los síntomas varía de persona a persona, y depende de la susceptibilidad al azúcar y la cantidad ingerida. Por esa razón, en el campo de la biotecnología ha adquirido gran importancia el estudio de enzimas que se pueden usar para la producción de leche y derivados lácteos sin lactosa, como es la β-galactosidasa de la bacteria Thermotoga maritima o TmLac”, explica Julio Polaina, investigador del CSIC en el IATA.
Rafael Fernández-Leiro añade que “hemos empleado la técnica de criomicroscopía electrónica o Cryo EM, que se ha convertido en una alternativa a la difracción de rayos X tradicionalmente empleada para resolver la estructura de macromoléculas a alta resolución. La estructura de la enzima TmLac se había intentado resolver anteriormente sin éxito. Gracias a la Cryo EM hemos podido resolver su estructura con una resolución de dos ángstroms, una de las más altas resoluciones conseguidas hasta la fecha empleando esta técnica y que nos permiten ver en detalle la estructura atómica de esta enzima”.
“Nuestra innovación supone una importante contribución a la salud y bienestar de la extensa población que presenta distintos grados de intolerancia a la lactosa. Un siguiente paso es el diseño de enzimas híbridas que puedan unirse de manera eficiente a diferentes soportes sólidos y así emplearse para distintas aplicaciones”, concluye Julia Sanz-Aparicio.
Samuel Míguez Amil, Elena Jiménez-Ortega, Mercedes Ramírez-Escudero, David Talens-Perales, Julia Marín-Navarro, Julio Polaina, Julia Sanz-Aparicio y Rafael Fernández-Leiro. The cryo-EM Structure of Thermotoga maritima β‑Galactosidase: Quaternary Structure Guides Protein Engineering. ACS Chem. Biol. DOI: 10.1021/acschembio.9b00752
Imagen: Estructura de la enzima ß-galactosidasa obtenida mediante criomicroscopía electrónica.

